日本糖尿病協会倫理委員会では、日本糖尿病協会会員からの「人を対象とする生命科学・医学研究」の倫理審査申請を受け付けます。
倫理指針
倫理審査は、下記の倫理指針に則って実施いたします。研究計画の作成、審査申請にあたってはあらかじめ十分にご参照ください。
文部科学省・厚生労働省・経済産業省 (令和3年3月23日/令和5年3月27 日一部改正 )
「人を対象とする生命科学・医学系研究に関する倫理指針」ガイダンス
「ICR臨床研究入門」(ICRweb) URL:https://www.icrweb.jp/
「研究倫理指針の解説2023年版」
(https://www.icrweb.jp/course/show.php?id=43)
・外部サイトです。日糖協の運営するeラーニングではありません。
・登録すれば無料で視聴できます。
・研究倫理に関する研修等も、こちらのICRwebのサイトで履修することができます。
※修了証の発行には費用がかかります。
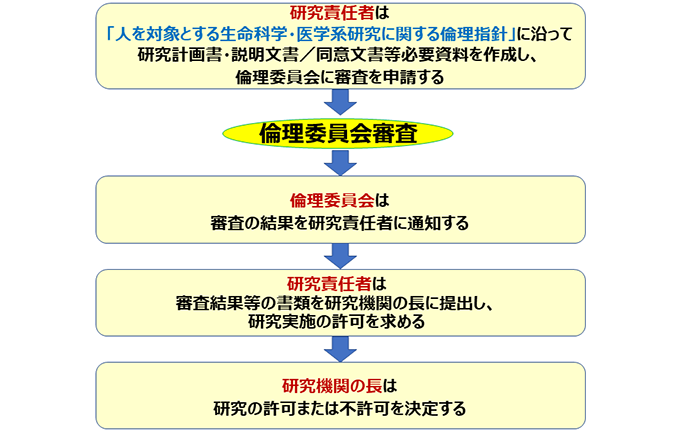
倫理審査の流れ
申請要件
- 研究責任者および分担研究者は研究倫理等に関する研修等を受講していること
- 研究責任者は日本糖尿病協会会員であること
- 研究責任者の所属施設に倫理審査委員会がないこと
- 臨床研究法に定める特定臨床研究ではないこと
1)研修の受講ができていない場合には、上記の「ICR臨床研究入門」(ICRweb)のeラーニングで学習することも可能です。ICRwebでの学習をもって研究倫理等に関する研修等を受講とする場合は、「臨床研究の基礎知識講座」を受講の上、修了証を添付してください。なお、「臨床研究の基礎知識講座」の第10章では「人を対象とする医学系研究に関する倫理指針」の解説が掲載されておりますが、現在適用の指針は、「人を対象とする生命科学・医学系研究に関する倫理指針」となっておりますので、あわせて「研究倫理指針の解説2023年版」もご視聴ください。
2)医療機関等に設置の友の会や各都道府県の糖尿病協会にご所属の方も、日本糖尿病協会の会員です。会員の方には、毎月さかえが届いています。新規入会はこちらまで。
審査費用
- 本審査が必要な研究計画(介入研究等):3万円
- 迅速審査が可能な研究計画(観察研究等):1万円
本審査が必要か、迅速審査が可能かは、研究の介入の有無、侵襲の有無によって決まります。<倫理指針ガイダンス>
上記のICRwebの倫理指針の解説を参照してください。
なお、当面は2.迅速審査が可能な研究計画のみの受付といたします。
研究計画書・同意説明文書等の記載事項確認
必要事項が記載されているか、それぞれチェックシートを用いて確認してください。
・計画書等に記載がある項目はチェック欄に○をつけ、記載場所欄に記載ページ・行を記入してください。
・該当しない項目はチェック欄に-を記入してください。
・必要事項が記載されていない研究計画は受付できません。
研究計画書チェックシート
同意説明文書チェックシート
情報公開文書(オプトアウト)チェックシート
研究計画書作成にあたっての注意点
観察研究の場合、下記の点が明確に読み取れるように研究計画書を作成してください。
- 「誰が」→<研究責任者・分担研究者>
- 「誰の」→<研究対象者>
- 「いつの」→<調査対象期間>
- 「何の」データを→<方法>
- 「いつからいつまでの期間に」→<研究実施期間>
- 「どのように利用するか」→<方法>
同意説明文書・オプトアウト文書においても同様です。
1.方法
研究計画書の「方法」には、研究として実際に行うことを正確に記載してください。
<例>
[方法]
例1)「2型糖尿病患者を対象に、薬剤Aを投与しカルテ情報を収集する。」
例2)「薬剤Aを通常診療で投与されている2型糖尿病患者を対象に、カルテ情報を収集する。」
例1では、研究としてAという薬剤を投与するという医療行為を行うことになるので、「介入」研究になります。
例2では、既存の診療情報の収集なので、「介入」研究にはなりません。
実際は例2のように診療情報の収集であるのに、「方法」として例1のように記載している場合が散見されます。診療情報を用いた観察研究の際はご注意ください。
2.研究期間
研究実施期間は、「方法」に記載していることを実施する期間です。
通常診療の診療情報を用いた観察研究の際は、カルテから必要な情報を抽出し、解析などの作業を行う期間が「研究実施期間」になります。
※研究実施期間は基本的に未来の日付になります。
対象とする診療情報の期間は「調査対象期間」であり、かならずしも「研究実施期間」とは一致しません。
※調査対象期間には過去の期間も含まれることがあります。
<例>
(審査申請)
2021年10月
(実施内容)
2020年1月から2022年3月までの期間に当院に通院した2型糖尿病患者の中で、薬剤Aを新規に処方された患者の、投与開始から3か月間のHbA1cの変化について、倫理審査承認日から2022年8月までの間に、患者背景との関連について解析を行う。
★この場合の各期間
研究実施期間:倫理審査承認日から2022年8月
調査対象期間:2020年1月から2022年6月
※2020年1月から倫理審査承認日までは、診療は行っており診療情報は記録されているが、その期間には「研究」は実施されていない。
※2022年3月に投与開始した症例の対象期間は6月まで
3.生体試料
「研究目的で」利用する血液等を指します。
通常診療で実施した血液検査のデータを利用する場合は、採血は診療として行われるだけなので、研究として生体試料を利用することにはなりません。
研究のために通常診療では実施しない検査に用いる場合には、「生体試料あり」となります。
倫理審査申請の手順
当面は迅速審査が可能な研究計画のみの受付といたします。
1)以下の資料を準備する
1.研究倫理審査申請書
申請書様式
2.研究計画書およびチェックシート
3.同意説明文書又は情報公開文書および各チェックシート
4.研究責任者ならびに分担研究者の研究倫理等に関する研修等の履修記録
5.その他、アンケート用紙等、研究実施に必要な資料
2)eメールで上記資料を日本糖尿病協会事務局に送付する
[eメール]:各資料の電子ファイル
・上記資料1-3は、テキストデータを抽出できる形式で送付してください。(word,excel等)
・PDF化はしないでください。
e-mail rinri@nittokyo.or.jp
3)事務局確認後、郵送で上記資料を日本糖尿病協会事務局に送付する
[郵送]:原紙およびコピー6部
※コピーは、上記1から5の資料を1セットにしたものを6セットご用意ください。
それぞれの資料を6枚ずつという送り方はしないでください。
〒102-0083
東京都千代田区麹町2-2-4麹町セントラルビル8F
公益社団法人日本糖尿病協会
倫理委員会
4)審査費用を入金する
申請受領メールにて入金先を通知します。
審査結果に関わらず審査費用は返金いたしません。
5)審査結果の回答期間の目安は下記のとおりです
申請を受領後3か月程度
年末年始、夏休みの期間は回答までに時間がかかることがあります。
内容に不備があった場合はこの限りではありません。
報告
研究計画が承認されましたら、研究責任者は、研究の進捗状況及び研究の実施に伴う有害事象の発生状況を報告してください。
報告がない場合、承認が取り消しとなる場合があります。
研究の進捗状況
毎年6月末日までに、前年度の進捗状況を上記様式にて報告
研究の終了・中止時
終了後3か月以内に、上記様式にて報告
[記入した様式をメール添付で送信]
e-mail rinri@nittokyo.or.jp
研究計画の変更
本委員会で承認した研究計画に変更が生じる際は、変更の申請を行ってください。
1)提出資料
1.研究倫理審査申請書(変更)
申請書様式
2.研究計画書および変更対比表
3.同意説明文書又は情報公開文書および変更対比表
2)eメールで上記資料を日本糖尿病協会事務局に送付する
[eメール]:各資料の電子ファイル
・上記資料、テキストデータを抽出できる形式で送付してください。(word,excel等)
・PDF化はしないでください。
e-mail rinri@nittokyo.or.jp
3)審査結果の回答期間の目安は下記のとおりです
申請を受領後3か月程度
年末年始、夏休みの期間は回答までに時間がかかることがあります。
内容に不備があった場合はこの限りではありません。
委員
| 委員長 | 馬場園 哲也 | 医師 | 東京女子医科大学 |
|---|---|---|---|
| 委員 | 渥美 義仁 | 医師 | 慈誠会・光が丘病院 |
| 委員 | 有光 孝生 | 一般 | 千葉県糖尿病協会 |
| 委員 | 中西 靖子 | 管理栄養士 | うんのクリニック |
| 委員 | 中村 智広 | 弁護士 | 弁護士法人フェアネス法律事務所 |
| 委員 | 山田 雅康 | 弁護士 | 山田雅康法律事務所 |
問い合わせ先
公益社団法人日本糖尿病協会 事務局
〒102-0083
東京都千代田区麹町2-2-4麹町セントラルビル8F
TEL:03-3514-1721 FAX:03-3514-1725
e-mail rinri@nittokyo.or.jp

