国内における65歳以上の高齢者人口は増加の一途をたどっており、2015年には4人に1人を高齢者が占めることが予想されています。
一方、糖尿病の患者数も、厚生労働省の2007年の糖尿病実態調査で890万人と推測され、2006年の前回調査から1年で70万人増となっています。加齢とともに糖尿病の頻度が増加することを加味すると、今後高齢者の2型糖尿病患者数の増加はさらに大きな社会問題となることが懸念されています。
わが国における高齢者糖尿病治療については、日本老年病学会等での研究はあるものの、広く認められている治療ガイドがなく、糖尿病治療薬の添付文書上では、画一的に「高齢者では、生理機能が低下していることが多く、低血糖があらわれやすいので、少量から投与を開始し定期的に検査を行うなど慎重に投与すること」と記載されているのみになります。そのため主治医の経験則によるところが大きく、適切なエビデンスが求められています。
そこで(社)日本糖尿病協会では、65歳以上の高齢2型糖尿病患者を対象とした医師主導の臨床研究「START-J」を計画するに至りました。
シタグリプチンは、2009年10月に国内初のインクレチン製剤として承認されたジペプチジルペプチダーゼ4(DPP4)阻害剤であり、その薬理学的特長から低血糖を引き起こさずに血糖降下作用が期待できる画期的な2型糖尿病新薬です。
本研究では、糖尿病治療の標準薬であるグリメピリドを対照薬として、シタグリプチンの有効性および安全性を比較検討し、糖尿病治療の進歩へ貢献することを目的としております。
諸先生方におかれましては、主旨をご理解いただき、何卒ご協力賜りますよう、よろしくお願い申し上げます。
社団法人日本糖尿病協会
(試験概要)
1:目的
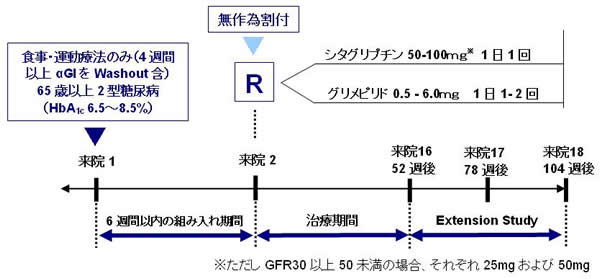
食事・運動療法のみ(アルファグルコシダーゼ阻害剤 [αGI] 単独療法で治療中の場合は4週間以上ウォッシュアウト後)で十分な血糖コントロールが得られていない65歳以上の2型糖尿病患者に対し、
A)シタグリプチン50mg1日1回投与を開始し100mgまで増量可とする群
(ただしeGFR30以上50未満の場合それぞれ25mgおよび50mg)
B)グリメピリド0.5mg1日1回投与を開始し6.0mgまで増量可とする群、
の2群に分け、有用性・安全性について検討する。
2:調査の分類
日本糖尿病協会 委託研究委員会を中心とした自主研究
3:対象
(1) 選択基準:2型糖尿病と診断された患者のうち、スクリーニング時に次の条件を全て満たす患者。
- 食事・運動療法単独、または、αGIの単剤療法(4週間以上ウォッシュアウト可能)を実施している2型糖尿病患者
ただし、αGIの単剤療法を実施している患者は4週間以上ウォッシュアウト後、割り付ける - 本試験への参加前に文書による同意が得られている
- スクリーニング時に食事・運動療法を12週間以上継続している患者
- スクリーニング時に年齢:65歳以上(性別不問)
- スクリーニング時にHbA1c:6.5%以上8.5%未満満
(2) 除外基準:次のいずれかの条件に該当する患者は除外する。
- 活動性のある増殖性網膜症または治療が必要な黄斑症
- 肝機能障害(トランスアミナーゼ正常上限の2倍以上)、腎機能障害(Cr>1.5(男性), >1.3 (女性) , eGFR<30 )、重度の心機能障害(NYHA III or IV)、悪性疾患またはコントロールのついていない高血圧(治療、未治療とも)のうち、担当医師が試験参加にふさわしくないと判断された者
- 精神的無能力(中等度および重度の認知症含む)のため、担当医師により十分な理解と協力が得られないと判断されたもの
- 繰り返す低血糖または無自覚低血糖のうち、担当医師により試験参加にふさわしくないと判断された者
- 重度の薬物アレルギーの既往
- ステロイド剤の全身投与を受けている被験者又は導入される可能性のある被験者
- 1型糖尿病(緩徐進行1型を含む)が疑われる患者或いは抗GAD抗体の陽性が確認されている被験者
- その他、担当医師が本試験への参加又は結果の評価の妨げになると危惧するその他の疾病又は病状を有する被験者
4:試験デザイン
スクリーニング時(来院1)に選択基準、除外基準に適合する患者を、来院2で無作為に下記に示すA群またはB群に割り付ける。
- A)シタグリプチン50mg1日1回投与を開始し100mgまで増量可とする群
(ただしeGFR30以上50未満の場合、それぞれ25mgおよび50mg) - B)グリメピリド0.5mg1日1回投与を開始し6.0mgまで増量可とする群
※ 本試験の登録・割付およびデータ収集はEDCシステムにより実施する。
5:観察・検査項目
- 被験者背景:生年月日、性別、糖尿病の発症時期、合併症、既往歴、前治療内容、 身長、体重等
- 観察・検査項目:臨床検査値、血圧、体重、治療遵守状況、低血糖症状の頻度、併用薬剤、有害事象等
6:試験実施期間
登録期間:
2010年6月末~2012年12月
追跡期間:
2010年6月~2013年12月(52週の臨床研究)
2010年6月~2014年12月(1年間のExtension Studyを含む)
7:目標症例数
900例(各群450例)を目標とし、52週終了時で540例以上(各群270例)
8:参加予定施設
全国約200施設程度を想定
9:その他
本研究から得られるデータの使用につきましては、MSD(株)と(社)日本糖尿病協会との間で、使用許諾契約を締結しております。
お問合せ先
公益社団法人日本糖尿病協会 事務局
TEL:03-3514-1721

